
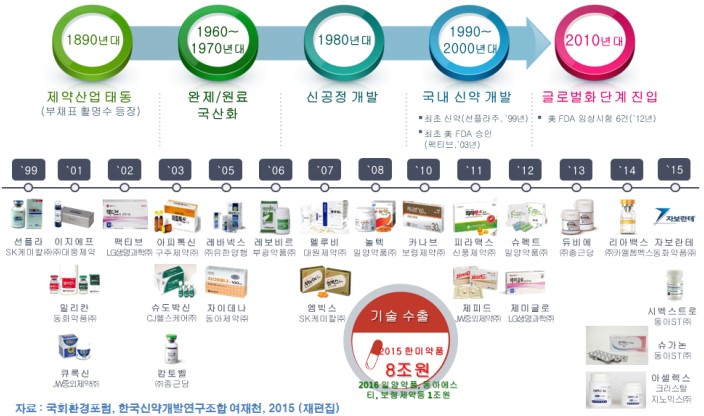
우리나라의 제약산업은 주로 완제 의약품을 수입 판매하던 단계에서 원료 의약품을 수입해 국내에서 제제화하고 공급하는 기초 제약기술을 확보하는 단계부터 시작됐다.
1962년, 한독약품이 서독의 훽스트와 처음으로 기술제휴를 맺고 국내에서 훽스트의 최신의약품을 국내에서 생산하기 시작한 이래로 많은 제약 업체들이 외국의 유명 제약기업들과 기술제휴 계약을 체결했다. 또한 합자회사 설립을 통해서 국내에 선진 기술 및 외자 도입도 추진했다.
1963년에는 종근당이 국내 최초로 항생제인 클로람페니콜의 원료를 직접 생산하기 시작했고, 1970년대에 원료 의약품의 합성 공정을 국내 기술에 의해서 자체적으로 개발하여 서서히 수입의약품을 대체하기 시작했다.
1974년, 유럽에서 일어난 탈리도마이드 복용에 의한 해면기형아 사건을 계기로 의약품재평가가 실시됐다. 보건사회부에서 GMP(Good Manufacturing Practice) 프로젝트팀을 구성하여 조사연구를 3년 동안 진행하여 1977년 KoreaGMP가 제정 고시되기도 했다.
1980년, 세계 경제가 완전 개방체제로 들어서면서 우리나라에 대해서 개방 압력이 거세지게 되어 의약품의 수입 자유화가 단계적으로 이루어지기 시작하면서 기업은 국가적인 지원 아래 의약품의 연구개발에 본격적으로 뛰어들었다.
1986년, 물질특허제도 도입에 대비하여 중외제약, 한미약품, 동아제약, 유한양행, 일양약품, 녹십자, 선경인더스트리, 한일약품, 종근당, 럭키, 제일제당, 태평양화학, 제일약품, 동화약품, 영진약품 등 15개 제약기업과 바이오테크기업들이 산업기술연구조합육성법에 의거 과학기술처 산하의 특별법인으로서 한국신약개발연구조합을 설립했고, 약 180개의 산`학`연`병이 국내외 오픈이노베이션 파트너쉽을 형성하여 신약개발에 매진하고 있다.
1987년, 물질특허 제도가 전면 실시되면서 우리나라에서도 신약 개발의 필요성이 높아졌다. 이전까지 국내에서는 물질 특허를 인정하지 않고 공정특허만 인정했기 때문에 다국적제약기업이 개발한 신약도 공정만 약간 바꾸어서 국내에서 판매할 수 있었다.
1996년 4월 보건복지부 산하에 식품의약품안전본부가 발족되어 보건복지부의 식품 및 의약품 등의 허가 업무와 감시 기능, 국립보건안전연구원의 독성 및 안전성 연구, 국립보건연구원의 식품 및 의약품 수거와 검사 기능 등 여러 기관에 분산돼 있던 기능을 통합해 해당 업무의 효율성을 높일 수 있게 됐다. 1998년에는 식품의약품안전청으로 승격됐다.
우리나라의 신약개발은 과학기술부의 기업주도 특정연구개발사업(1987-89), 그 후속으로 수행된 국책연구개발사업(1990-91)에 이어 선도기술개발사업이 1992년부터 1997년까지 총 6년 동안 G7 신의약 사업으로 본격 추진됐다. 이로써 신약개발의 전과정(기초, 응용, 공통기반, 제품화)을 대상으로 연구비가 지원됐고, 1998년 보건복지부로 기업의 신약개발지원 예산이 이관돼 보건의료기술사업의 일환으로 연계 추진됐다.
1990년대 이후 정부의 연구비 지원 규모가 확대 되면서 약학연구자를 중심으로 한 대형 연구 사업단과 연구 중심의 센터 과제, 우수 연구자를 대상으로 국가지정 연구실 사업 등의 다수 과제가 선정, 지원됐다. 또 2008년에는 첨단의료복합단지 지정 및 지원에 관한 특별법 제정으로 오송과 대구에 각각 국가첨단의료복합단지가 설립돼 신약개발 인프라지원구축이 시작됐다.
이어 2011년 미래창조과학부, 보건복지부, 산업통상자원부 3개 부처에서 300억원의 예산을 분담 지원하는 범부처신약개발지원사업이, 지식경제부에서 지원하는 글로벌천연물신약개발지원사업이, 보건복지부에서 지원하는 시스템통합적항암신약사업이 시작됐으며, 2014년에는 미래창조과학부가 지원하는 신약타깃 발굴 및 검증사업이, 2015년 미래창조과학부와 보건복지부에서 지원하는 첨단바이오사업(유전자치료제, 세포치료제)이 새롭게 출범됐다.
한편, 1970년대에 들어서면서 경제발전의 한 주체로서 제약업을 인정하고 그 육성발전을 위한 약사법 개정이 이루어졌다. 1971년 1월 13일 법률 제2279호로 개정 공포된 약사법 개정 법률은 신약의 개념을 정립해 신약의 허가 요건과 이에 대한 보호 육성을 할 수 있는 법적 근거가 마련됐다.
1983년 유전공학육성법(생명공학육성법) 제정, 2008년 천연물신약개발연구촉진법 제정, 2012년 제약산업발전육성법 제정과 시행을 통해서 신약개발 지원 근거법이 하나하나 정비됐다. 2016년 과학기술전략회의에서 4차 산업혁명 시대를 대비한 신약-바이오신산업이 9대 국가전략프로젝트의 하나로 선정됐다.
국내 제약사 신약개발 성과
과학기술처의 특정연구개발사업을 통해서 1987년 지원 받은 SK케미컬의 항암제 '선플라'가 1999년에 식품의약품안전청으로부터 우리나라의 국산신약 1호로 승인됐다.
민간자본만으로 연구 수행한 LG화학의 퀴놀론계 항균제 '팩티브'는 2003년에 미국FDA로부터 우리나라의 글로벌신약 1호로 승인되는 쾌거를 이루었다.
과학기술부, 보건복지부, 산업자원부에서 지원 받아온 ▷보령제약의 고혈압치료제 카나브정 개발, ▷동아ST의 항생제 시벡스트로정 개발, ▷당뇨병치료제 슈가논정 개발, ▷한미약품의 폐암치료제 올리타정 개발, 짧은 약효 지속 시간을 최대 월 1회까지 늘려주는 차별화된 독자적 기반 기술인 ‘LAPSCOVERY’를 적용한 다양한 바이오베터의 플랫폼기술수출, ▷종근당 항암제 캄토벨주 개발, 당뇨병치료제 듀비에정 개발, ▷LG화학 당뇨병치료제 제미글로정 개발, ▷동화약품 항생제 자보란테정 개발, 항암제 밀리칸주 개발, ▷신풍제약 말라리아치료제 피라맥스정 개발, ▷JW중외제약의 항암제 큐록신정 개발 이외에 스타트업의 수많은 신약파이프라인이 개발 단계를 거쳐서 국내 및 해외시장에서 계속 출시되고 있다.
2015년 7월 보령제약은 ‘카나브정’을 동남아 13개국 제약시장을 총괄하는 쥴릭파마코리아와 1억 2,900만 달러 규모의 계약을 체결했고, 12월 사우디아라비아 ‘SPC’사와 14만 달러, 2016년 5월 ‘카나브플러스’가 쥴릭파마사와 2,846만 달러에 수출 계약을 추가 체결했다. 2015 ~ 2016년 2년 동안 총 8건의 해외 기술수출로 약 2억7,918만 달러 규모의 계약을 성사시켰다.
<우리나라 제약/바이오BT 신약개발 Breakthrough>
신약개발 미래 전망
세계 제조업은 장기적인 경기침체, 노동 원가 및 원자재 가격 상승 등으로 성장 한계에 봉착했다. 그러나 ICT, 센서 기술의 급속한 발전으로 인해 성장 한계 돌파를 위한 제조업의 제4차 산업혁명의 시대가 열리게 됐다.
디지털혁명으로 정의되는 제3차 산업혁명의 기반 위에 바이오 등 기술융합을 통해서 제품과 서비스가 결합된 다양한 신시장이 창출되면서 기존 영역의 경계를 넘어서는 혁신적인 변화가 일어나고 있다.
글로벌 의약품 시장도 2000년 초반까지는 증상 완화 목적의 primary care drug이 블록버스터화 됐으나 최근에는 생존율 증대, 질병 진행 지연 등 specialty drug의 매출이 증대되고 있다. 시장점유율 도 2001년 13%에서 2012년 22%(1,890억달러)로 급상승하고 있다.
신약개발을 신산업으로 육성하기 위해서는 독점적인 혁신신약이 세계시장에 공급됨으로써 막대한 수익을 올리고 이러한 수익을 연구개발에 재투자할 수 있는 선순환 신약개발 경쟁력 구조가 강화돼야 한다.
다국적제약기업들의 요구에 상응할 수 있는 미충족 의료 니즈를 만족할 수 있는 신약개발 오픈이노베이션 파트너쉽 사업모델이 지속적으로 창출된다면 우리나라 제약기업이 다국적제약기업으로 조기 성장할 가능성은 매우 높다.
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

