[팜뉴스=김민건 기자] 지난 몇년 간 재발성∙진행성 불일치 복구결함(dMMR)/고빈도 현미부수체 불안정(MSI-H) 자궁내막암 치료에서 젬퍼리(도스탈리맙)처럼 빠르게 급여권에 진입한 면역항암제는 없다. 젬퍼리는 최대 규모 임상에서 보인 객관적 반응을 포함해 2년 3개월에 달하는 지속된 효과로 자궁내막암 치료에 큰 영향을 미치고 있다.
이전까지 재발·진행성 자궁내막암 2차 치료에서 화학항암요법의 생존기간 중앙값 1년은 좌절을 안겼다. 그러나 젬퍼리는 많은 사람들을 놀라게 했다. FDA가 혁신치료제(Breakthrough Therapy)로 지정·가속승인하며, 유럽에서도 dMMR/MSI-H 자궁내막암에 단독으로 사용할 수 있는 첫 PD-1 저해제로 허가한 이유다.
반짝이는 새로운 면역항암제 젬퍼리를 의료 현장과 환자들이 기대하는 것은 당연할 수밖에 없다. 김희승 서울대병원 산부인과 교수는 "젬퍼리는 오랫동안 발전이 없었던 재발성·진행성 자궁내막암 치료 분야에 면역항암제 시대를 본격화한 혁신신약이다"고 말했다.
미국종합암네트워크(NCCN), 유럽종양학회(ESMO) 가이드라인은 재발성·진행성 dMMR/MSI-H 자궁내막암 치료에 PD-1 저해제 단독요법으로 젬퍼리를 권고하며, NCCN 가이드라인은 2차 치료에서도 젬퍼리를 권고하고 있다. 이러한 설명이 젬퍼리의 혁신성을 보여주지만 불충분할 수 있다.
기존 치료요법의 부족한 성적으로 미충족 수요가 큰 자궁내막암에서 젬퍼리의 혁신성은 생각 이상이다. 김 교수는 "FDA가 지정한 혁신치료제이자 유럽에서 단독 사용 가능한 젬퍼리가 국내에서도 자궁내막암 치료에 급여 적용된 첫 면역항암제가 돼 환자들이 임상적 혜택을 누릴 수 있도록 정책적 지원이 확대되길 바란다"고 말했다.
젬퍼리는 작년 12월 국내 허가를 받은 지 8개월 만에 약제급여평가위원회 문턱을 넘었다. 긍정적인 기대감을 갖게 한다. 급여가 된다면 부인암 대상으로 적용된 첫 면역항암제로 이름을 남기게 된다.
▶제한적 항암화학요법, 증가하는 환자...새로운 패러다임 제시한 최대 규모 연구
국내 자궁내막암 치료 환자는 2017년 1만7421명에서 2021년 2만3262명으로 34%나 늘었다. 급속히 증가하는 환자는 우리가 젬퍼리를 주목하는 이유 중 하나다.
자궁내막암 대부분 조기에 진단할 경우 치료가 가능하다. 하지만 4명 중 1명은 재발하거나 진행성 자궁내막암으로 병이 악화한다. 이 경우 평균 생존기간은 1년 미만으로 예후가 좋지 않다. 기존 항암화학요법 효과가 제한적임에도 재발 시 표준치료가 정립돼 있지 않다는 사실은 치료를 더 어렵게 한다.
하지만 기존 항암화학요법 보다 뛰어난 효과에 낮은 부작용을 가진 면역항암제는 달랐다. 젬퍼리는 자궁내막암 치료 패러다임을 바꿀 수 있는 새롭고 효과적인 수요임을 임상 연구에서 보였다. 국내 급여 적용이 될 경우 실제적 치료 혜택을 가장 반길 이들은 현장 의사와 환자들일 것이다.
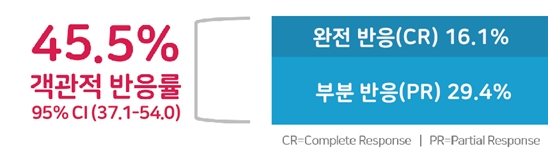
젬퍼리는 용량 증량 연구가 목적인 1상 GARNET 연구(143명)에서 객관적 반응률(ORR) 45.5%를 확인하고, 그 효과는 추적관찰기간 27.6개월(2년 3개월) 동안 중앙값에 도달하지 않을 만큼 지속적인 항종양 반응을 보였다. GARNET은 현재까지 MMR/MSI-H 자궁내막암에서 PD-1 면역항암제 단독요법을 평가한 최대 규모 연구다. 재발 후 2차 치료에 주로 사용하는 항암화학요법 생존 중앙값이 1년 미만인 상황에서 젬퍼리가 보인 데이터는 매우 놀라운 수치임에 틀림 없다.
가장 먼저 젬퍼리 효과는 반응률에서 알 수 있다. 젬퍼리 투약 환자에서 암세포가 완전히 사라지거나 증상이 없어지는 '완전반응(CR)' 환자는 16.1%, 부분적으로 항종양 반응을 보인 경우는 29.4%가 됐다.
완전반응과 부분반응을 포함해 암세포 성장을 억제하는데 성공한 비율을 의미하는 질병조절률(Disease Control Rate, DCR)는 60.1%까지 올랐다. 이 경우 치료 반응은 12개월, 24개월간 각각 93.3%, 83.7%로 나타나 성공적으로 분석됐다. 젬퍼리에 반응을 보인 환자는 최소 1~2년은 효과가 지속된다는 것을 의미한다.
이 연구에서 주요한 2차 평가변수는 무진행생존기간(Progression Free Survival, PFS)과 전체 생존율(Overall Survival, OS)이다. 무진행생존기간 중앙값은 6개월(최소 4.1개월에서 18개월)로, 젬퍼리를 맞은 환자가 병 진행 없이 생존한 기간이 최소 4개월에서 최대 18개월이며, 그 가운데 값이 6개월일 정도로 효과가 있었다는 뜻이다.
무진행생존기간에 이어 분석하는 전체생존기간은 데이터 확정 시점(data cut-off)까지 중앙값에 도달하지 않았다. 가장 중요한 데이터로 2년 3개월 이상 장기 생존 효과를 보고 있다는 의미다.
생존 효과에 반해 부작용은 경미하거나 적었다. 치료 관련 이상반응(TRAEs, Treatment-related Adverse Events)은 대부분 1~2등급이었다. 가장 흔한 이상반응은 설사(16.3%), 무기력증(15.7%), 피로감(13.7%)으로 비교적 쉽게 관리가 가능하다.
오히려 투약 횟수가 늘어날수록 삶의 질이 올라갔다. 젬퍼리는 3주에 한 번씩 4주기(4 cycle) 동안 500mg을 정맥 투여하는 면역항암제다. 그 이후부터는 질병이 진행되거나 심각한 독성 발현까지 6주마다 1000mg을 투여한다. 임상에서 젬퍼리를 7사이클을 맞은 환자는 통증, 피로감, 정서 등 신체적인 기능뿐 아니라 정서적 측면에서도 유의미한 향상이 확인됐다.
▶허가 8개월 초고속 진입, 국내 첫 자궁내막암 면역항암제 급여화 시대 앞둬
김희승 서울대병원 산부인과 교수는 "젬퍼리는 오랫동안 치료 발전이 없었던 자궁내막암 분야에서 우수한 효과와 양호한 안전성을 바탕으로 면역항암제 시대를 본격화할 것"이라고 전망했다.
이에 그는 "하루 빨리 급여 절차를 마무리해 자궁내막암 치료 분야의 표준 치료로서 더 많은 환자들에게 임상적 혜택을 제공할 수 있기를 기대한다"고 거듭 강조했다. 작년 12월 재발성 또는 진행성 dMMR/MSI-H 자궁내막암 2차 치료제로 식약처 허가를 받은 젬퍼리에 대한 기대치가 그만큼 높다는 것을 반증한다.
젬퍼리는 기존 면역항암제들이 처방 폭을 확대한 것과 달리 첫 번째 허가 적응증부터 자궁내막암으로 받은 최초의 면역항암제다. 그만큼 국내 급여 절차도 빠르게 진행되고 있다.
올해 6월 열린 2023년 제4차 암질환심의위원회에서 '이전 백금기반 전신 화학요법의 치료 중이거나 치료 후 진행을 나타낸 재발성 또는 진행성dMMR/MSI-H 자궁내막암 성인 환자 치료'에 급여기준을 설정받았다. 허가 반년 만에 암질심을 통과했다. 지난 8월에는 2023년 제8차 약평위에서 급여 적정성을 인정받았다. 이례적인 급여화 속도다.
미국과 유럽 등 주요 국가는 임상 유효성과 안전성 데이터를 바탕으로 사용 중에 있다. 전세계 환자를 비롯한 주요 약가 참조 A8 국가 중 미국, 독일, 영국, 스위스, 이탈리아 등 5개국은 급여를 등재했으며, 영국 NICE는 자궁내막암에 젬퍼리 급여를 권고하고 있다.
관련기사
개의 댓글
댓글 정렬
그래도 삭제하시겠습니까?

